中3理科「中和と塩」対策問題です。
中和反応は、よく入試で出題される単元の1つです。今回の「塩酸と水酸化ナトリウムの中和」「硫酸と水酸化バリウム水溶液の中和」「硝酸と水酸化カリウム水溶液の中和」は確実におさえておきたいところです。
【ポイント】中3理科「中和と塩のポイントまとめ」
中和の対策問題
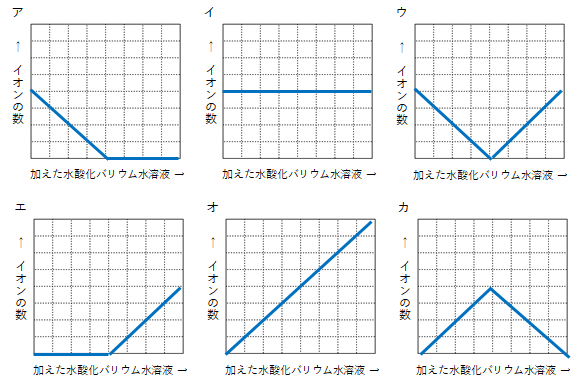
【問1】ビーカーの中にうすい硫酸が溶けている。そこに、少しずつ水酸化バリウムをずっと加えていくとき、ビーカー内の①水素イオン、②水酸化物イオン、③ビーカー内のイオンのそれぞれのイオンの数の増減の様子のグラフをそれぞれ選べ。
<グラフ>
【問2】酸とアルカリの水溶液を混ぜ合わせたときに起こる変化について調べる実験を行いました。その実験の手順と結果を読んで、次の問いに答えなさい。
<手順>
- うすい塩酸40mLをビーカーに入れ、フェノールフタレイン液を少量加えた。
- 水酸化ナトリウムを水に加えて、4%の水酸化ナトリウム水溶液を100gつくった。
- 2でつくった水酸化ナトリウム水溶液を、1のビーカーに少しずつ加えていった。
- 加えた水酸化ナトリウム水溶液の体積が70mLになるまで、水酸化ナトリウム水溶液を加えていき、水酸化ナトリウム水溶液を加えるたびに、ビーカー内の液を色を調べた。
<結果>
加えた水酸化ナトリウム水溶液の体積が50mLになるまでは無色であったが、それ以降はある色に変化した。
(1)手順2で、水酸化ナトリウム水溶液をつくったとき、水酸化ナトリウムを加えた水の質量は何gか求めよ。
(2)<結果>に出てくる「ある色」とは、何色か答えなさい。
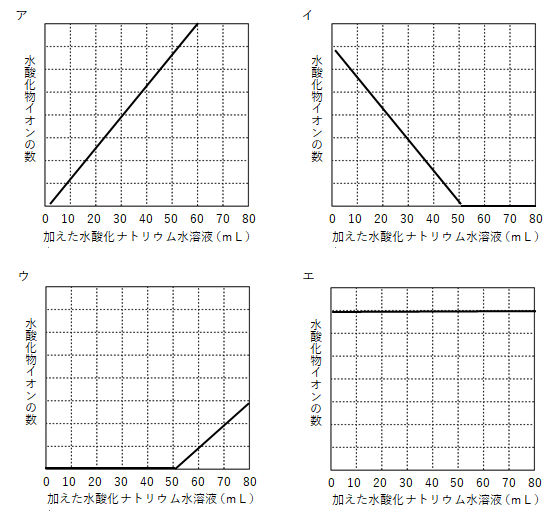
(3)手順3,4を行っている間、ビーカー内の液中に存在している水酸化物イオンの数を変化を表したグラフとして適切なものを次のア~エを1つ選びなさい。
(4)次の文章の( )に適語を入れよ。
手順3のように、うすい塩酸に水酸化ナトリウム水溶液を加えると、互いの性質を打ち消し合う( )とよばれる化学変化が起こる。一般に、この化学変化が起こると、水ともう1つの物質を生じる。このとき生じた、水以外の物質をまとめて( )という。
中和の練習問題の解答
【問1】
①水素イオン=ア
水素イオンの数:硫酸イオンの数=2:1 バリウムイオンの数:水酸化物イオンの数=1:2ということを頭に置いて、うすい硫酸に少しずつ水酸化バリウムを加えていく場合
最初にあるのは、うすい硫酸なので、水素イオンと硫酸イオン
水酸化物イオンが水素イオンと結びついて水になる。(水素イオンが減少、水酸化物イオンは0)
バリウムイオンは硫酸イオンと結びついて硫酸バリウムになる。(硫酸イオンが減少、バリウムイオンは0)
最初にあるのは、うすい硫酸なので、水素イオンと硫酸イオン
水酸化物イオンが水素イオンと結びついて水になる。(水素イオンが減少、水酸化物イオンは0)
バリウムイオンは硫酸イオンと結びついて硫酸バリウムになる。(硫酸イオンが減少、バリウムイオンは0)
②水酸化物イオン=エ
水酸化バリウムを適量加えたところで中性
硫酸バリウムと水だけになる。(硫酸バリウムはイオンにならず、白い沈殿として残る。イオンの状態のものはない。)
硫酸バリウムと水だけになる。(硫酸バリウムはイオンにならず、白い沈殿として残る。イオンの状態のものはない。)
③ビーカー内のイオン=ウ
さらに水酸化バリウムを加えていくと、アルカリ性<
バリウムイオンと水酸化物イオンが反応できずに増える。(水酸化物イオンの数はバリウムイオンの数の2倍の割合で増える。)
バリウムイオンと水酸化物イオンが反応できずに増える。(水酸化物イオンの数はバリウムイオンの数の2倍の割合で増える。)
【問2】
(1)96g
水酸化ナトリウム=100×0.04=4g
水=100-4=96g
(2)赤色
(3)ウ
(4)中和 / 塩


コメント