中3理科「いろいろな電池のポイントまとめ」入試でもよく出るところです。しっかり理解していきましょう。
いろいろな電池
- 一次電池…一次電池は使い捨ての電池です。使い捨てというのは、一度使い切ったら再び充電して使うことができません。使い切ったら、新しい電池に取り替える必要があります。例えば、リモコンや時計に使われているアルカリ電池が一次電池の代表的な例です。使い終わったら、そのまま捨ててしまいます。<例>マンガン電池、ボルタ電池
- 二次電池…二次電池は充電式の電池です。一度使い切ったら、再び充電して使うことができます。つまり、使い終わった後に捨てる必要がありません。スマートフォンや携帯ゲーム機、カメラなどに使われている充電式の電池が二次電池です。<例>鉛蓄電池、リチウムイオン電池
- 燃料電池…燃料電池は燃料である水素と酸素を供給すると電気を作りつづける発電装置。つまり、外から燃料を与えるといつまでも電気を作り続ける電池。
ボルタの電池のしくみ
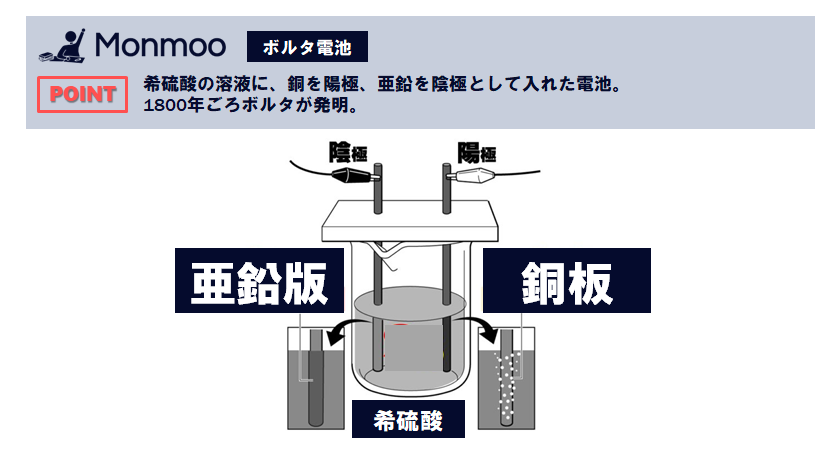
うすい硫酸に+極として銅板、-極として亜鉛板を使った電池をポルタの電池といいます。起電力は約1ボルト(V)で、電流は 銅板から導線を通って亜鉛板のほうに流れ、銅板の表面には水素が発生します。
銅と亜鉛では亜鉛のほうがイオンになりやすいです。したがって、導線でつないだ銅板と亜鉛板をうすい硫酸に入れると、亜鉛板から亜鉛が電子を残し、イオンとなってとけ出します。この残った電子が、亜鉛板→導線→銅板と移動して、銅板の表面で、うすい硫酸中の水素イオンに与えられます。
このようにして、つぎからつぎへと電子が移動するので、銅板から亜鉛板の向きに電流が流れます。また、電子をもらった水素イオンは水素原子となり、その水素原子は2個結びついて、水素分子となって銅板付近に発生します。
実験の注意点
銅板と亜鉛板は導線などで接続しているときとしていないときの違いです。いずれにしても、銅板と銅板では気体は発生しません。
接続しているとき
銅板は+極、亜鉛板は-極の電池になります。亜鉛板はゆっくりとボロボロになっていき、銅板から水素が発生します。
(-極) Zn → Zn2+ + 2e-
(+極) 2H2O → H2 + 2OH–
接続していないとき
亜鉛板と硫酸が反応し、水素が発生します。
- Zn + H2SO4 → ZnSO4 + H2
ただし、亜鉛は希硫酸とはよく反応しますが、濃硫酸との反応は遅いです。銅板は濃硫酸や希硫酸とは反応しませんが、熱濃硫酸とは反応し、二酸化硫黄を発生させます。
- Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
身近な物質から電池をつくる (例)
わたしたちの身近なところに ある物質を用いて、いろいろな電池をつくることができます。
- 木炭を使った電池…備長炭とよばれる木炭を用いて、電池のはたらきをさせることができます。
以上が、中3理科の「ボルタの電池」亜鉛と銅板に薄い硫酸を入れる実験となります。
燃料電池
水素と酸素の化学反応から電気を取り出す仕組みで、発生する物質が水だけなのでクリーンである燃料電池についてです。
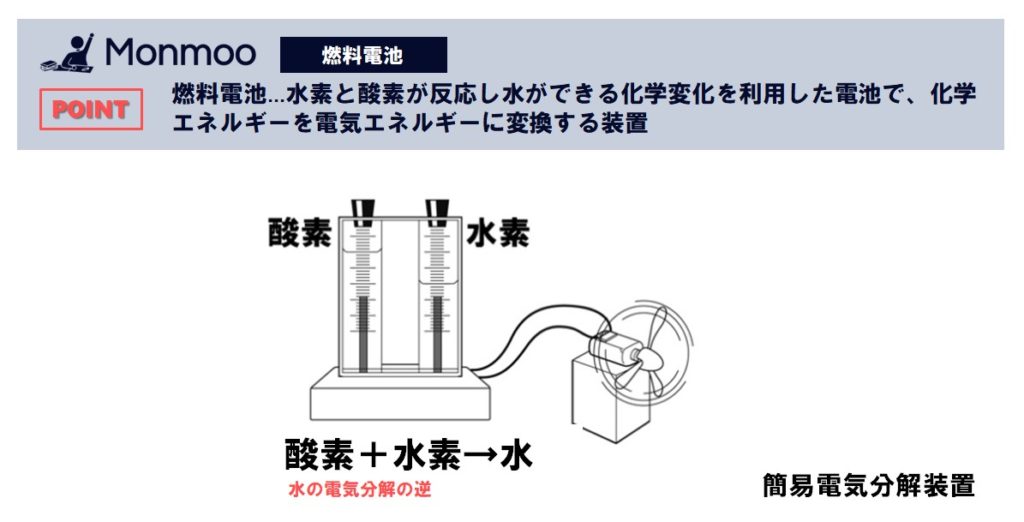
水素と酸素の反応による化学エネルギーから、直接電気エネルギーを取り出す装置を燃料電池といいます。原理的には水の電気分解の逆の反応を起こし発電していることになります。
水素-酸素燃料電池
水の電気分解をしばらく行ってから、電源をはずし、電極に太陽電池用モーターにつなぐとモーターが回転します。このときの反応は、水の生成と同時に電気エネルギーを取り出していることになります。
- 水素+酸素→水+電気エネルギー
- 2H2+O2→2H2O
水素と酸素が反応するときには、水だけが生じていることになり、有機物の燃焼などから電気エネルギーをつくり出すのに比べて、熱エネルギーなどの損失が少ないため効率がよく、二酸化炭素も発生しないので、クリーンなエネルギー源を考えられます。
燃料電池の利用
電気自動車の電源に利用されています。かつては、スペースシャトル内での発電などで利用されていて、多くの水をもちこめないスペースシャトルでは反応でできる水を飲料水にも利用していました。家庭などに広く普及させる研究開発が進められています。
●化学変化と力学的エネルギー
自動車では、エンジンのシリンダー中でガソリンと空気の混合気体を圧縮・爆発させ、そのエネルギーを動力に利用しています。また、大規模な土木工事やビルの解体などで利用されているダイナマイトも爆発のエネルギーを利用している例でもあります。●化学変化と光エネルギー
薬品で混ぜ合わせることで発光することがあり、ケミカルライトとして利用されています。

コメント