中3理科「水溶液とイオン」対策問題です。
【問題】水溶液とイオンの対策問題
【問1】次の図はヘリウム原子の構造を示したものである。これについて、次の問いに答えなさい。
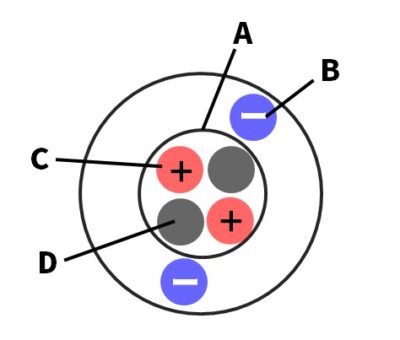
(1)+の電気をもったAを何というか。
(2)-の電気をもったBを何というか。
(3)Aは、+の電気をもったCと、電気をもっていないDかでできている。C,Dをそれぞれ何というか。
(4)BとCの質量はどちらが大きいか。
(5)Bが1個がもっている-の電気の量と、Cが1がもっている+の電気の量の関係はどうなっているか。
(6)ふつうの上代では、原子の中のBの数とCの数はどうなっているか。
(7)(5)と(6)から、原子は全体として電気的にどのような状態になっているか。
【問2】次の表のア~エの4種類の水溶液について、リトマス紙の色の変化、BTB溶液の家路の変化、マグネシウムリボンを入れたときの変化をそれぞれ調べた。次の問いに答えなさい。
| ア | うすい塩酸 |
| イ | アンモニア水 |
| ウ | うすい水酸化ナトリウム水溶液 |
| エ | うすい塩酸 |
(1)うすい塩酸を赤色リトマス紙と青色リトマス紙についたときの変化をそれぞれ答えよ。
(2)アンモニア水に、緑色のBTB溶液を加えると、何色に変化するか。
(3)マグネシウムリボンを入れた時、気体が発生する水溶液を表から2つ選び、記号で答えよ。
(4)(3)で発生する気体は何か。気体名を答えよ。
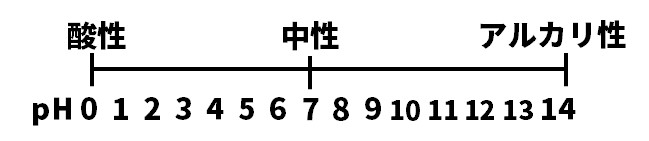
(5)pHの値が7より大きい水溶液を表からすべて選び、記号で答えよ。
【問3】図は、塩酸や水酸化ナトリウムが電離したときの電離の様子を示したもので、⊕は陽イオンを、⊖は陰イオンを表している。
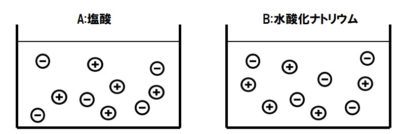
(1)pH試験紙を塩酸につけると、何色に変色するか。記号で選べ。
あ:白色
い:青色
う:赤色
え:黄色
お:緑色
か:紫色
(2)Bの陽イオンと陰イオンは、それぞれ何か。イオンの名称を答えよ。
(3)塩酸にBTB液を入れると、何色に変色するか。(1)の色の中から記号で答えよ。
(4)水酸化ナトリウム水溶液にフェノールフタレイン液を入れると、何色に変色するか。(1)の色の中から記号で答えよ。
(5)pHが1.2の塩酸とpHが3.4の塩酸では、どちらの方が酸性が強いか。
【問4】
- 水に溶けると電流を流す物質を何というか。
- 水に溶けても電流を流さない物質を何というか。
- 次の中から非電解質をすべて選べ。
ア 砂糖 イ 食塩 ウ 塩化水素 エ エタノール オ デンプン - 物質が水に溶け、陽イオンと陰イオンに分かれる物質を何というか。
- 物質が水に溶け、陽イオンと陰イオンに分かれることを何というか。
- 塩化ナトリウムが水に溶けて陽イオンと陰イオンに分かれる様子を、化学式とイオン式で表せ。
- 塩化銅が水に溶けて、陽イオンと陰イオンに分かれるようすを、化学式とイオン式で表せ。
【問5】次の文は、電池ができる条件についてまとめたものです。a,bに入る適切な言葉の組み合わせを、次のア~エから1つ選びなさい。
ア a=電解質 b=同じ種類
イ a=電解質 b=2種類
ウ a=非電解質 b=同じ種類
エ a=非電解質 b=2種類
【問6】
- このしくみで電池を取り出す装置を何というか。
- +極としてはたらいているのは、銅板と亜鉛版のどちらか。
- モーターが回転しているとき、銅板から発生する気体は何か。
- 銅板と亜鉛版につながる導線の端子を入れ替えると、モーターの回転はどうなるか。
- うすい塩酸を砂糖水に取りかえたら、モーターの回転はどうなるか。
- 塩化銅を水にとかしたときの電離のようすをイオン式で書け。
- 陽極で発生した気体の説明として、最も適当なものを次のア~エより選べ。
ア 水に少し溶け、水溶液は酸性を示す。石灰水を白く濁らせる。
イ 水に非常に溶けやすく、水溶液はアルカリ性を示す。肥料の原料として利用されます。
ウ 水に非常に溶けやすく、水溶液は強い酸性を示します、この気体の水溶液が塩酸である。
エ 水に溶けやすく、水溶液は酸性を示す。赤色の水性インクを脱色する。
【解答】水溶液とイオンの対策問題
【問1】
(1)原子核
(2)電子
(3)C陽子 D中性子
(4)C
(5)等しい
(6)等しい
(7)中性になっている
【問2】
(1)
赤色リトマス紙:変化なし
青色リトマス紙:赤色に変化する
(2)青色
(3)ア・エ
(4)水素
(5)イ・ウ
【問3】
(1)う
(2)
陽:ナトリウムイオン
陰:水酸化物イオン
NaOH → Na⁺ + OH⁻
化学式の前にあるNaが陽イオン、後のOHが陰イオンになります。
(3)え
(4)う
(5)pHが1.2の塩酸
【問4】
- 電解質
- 非電解質
- ア、エ、オ
- 電解質
- 電離
- NaCl→Na++Cl–
- CuCl2→Cu2++2Cl–
【問5】
イ
電池とは、電解質の水溶液に異なった2種類の金属板を入れることによっておこる化学反応を利用して、電流を取り出すようにしたものです。非電解質の水溶液や同種類の金属板では、化学変化は起こらないので、電池にはなりません。
【問6】
- 電池(化学電池)
- 銅板
- 水素
- 反対向きに回転する
- 回転しなくなる
- CuCl2→Cu2++Cl–
- エ

コメント