中3理科「水溶液とイオンのポイントまとめ」です。
【ポイント】イオン
原子は陽子(+)の数と電子(-)の数が等しく電気的に中性でしたが、電子を失ったり、電子を受けとったりすると、+や-の電気を帯びます。電気を帯びると原子とは言わずにイオンとよばれる粒になります。
- 陽イオン…イオンの中でも+の電気を帯びたイオン
- 陰イオン…イオンの中でも-の電気を帯びたイオン
イオンの種類
いくつかの原子が集まってイオンになるものもあります。
| 陽イオン | 陰イオン |
| 水素イオン H+ | 塩化物イオン Cl– |
| ナトリウムイオン Na+ | 水酸化物イオン OH– |
| カリウムイオン K+ | 硫酸イオン SO42- |
| カルシウムイオン Ca+ | 硝酸イオン NO3– |
| 銅イオン Cu2+ | |
| 亜鉛イオン Zn2+ | |
| アンモニウムイオンNH4+ |
原子の構造
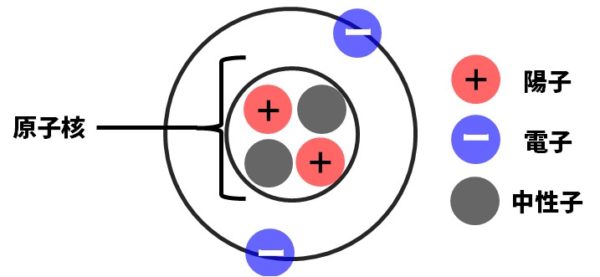
原子とは、物質をつくっている最小の粒で、それ以上分解できない粒。原子の中心には原子核というつくりがあり、原子核の中には+の電気を帯びた陽子、電気を帯びていない中性子が入っています。そして、その原子核のまわりを-の電気を帯びた電子という粒子が回っています。
原子では、必ず、陽子の数と電子の数が同じになっています。プラスの電気を帯びた陽子の数と、マイナスの電気を帯びた電子の数が同じですので、原子全体としては電気を帯びていない状態になります。
原子の記号
原子の記号とは、原子の種類を表す記号のことであり、ラテン語や英語、ドイツ語などで書いた元素の名前のかしら文字やかしら文字とつづり字の中の1字を組み合わせたもので表されている。また、この記号は、同時にそれぞれの元素の1原子も意味しているため、元素記号ともいう。
原子の記号の書き方
記号の第1文字は評体の大文字で書く。第2文字を書くときは、第1文字の右下に、活字体または筆記体の小文字を書く。
〈例〉
- 水素H
- 酸素O
- 窒素N
- 炭素C
- 亜鉛Zn
- 銅Cu
- 鉄Fe
- 塩素Cl
- 水銀Hg
など
元素について
物質をつくるもとになる成分を元素という。元素には多くのものがあり、現在約100種類以上が知られている。単体も元素も1種類の原子からできているものである。
そのちがいを水で説明するとつぎのようになる。 「水を分解すると、水素と酸素ができる。」というのは、水素と酸素を単体として扱った場合のいい方であり、物質という立場からみた用語である。
【ポイント】電解質と非電解質
電離とは、物質が水に溶けて、陽イオンと陰イオンに分かれることです。
- 電解質は、水に溶けて電離します。電解質の水溶液に電流が流れるのは、水溶液中にイオンが存在するから。(例)食塩(塩化ナトリウム)、塩化水素、水酸化ナトリウム、塩化銅など
- 非電解質は、水に溶けても電離せず、分子のまま存在している。(例)砂糖やエタノール、ブドウ糖など
<例>
- 食塩(塩化ナトリウム)は水に溶けるとナトリウムイオン(Na+)と塩化物イオン(Cl–)に電離します。
- 砂糖は水に溶けても分子のままで存在する非電解質で、電流が流れません。
【ポイント】塩化銅の電気分解
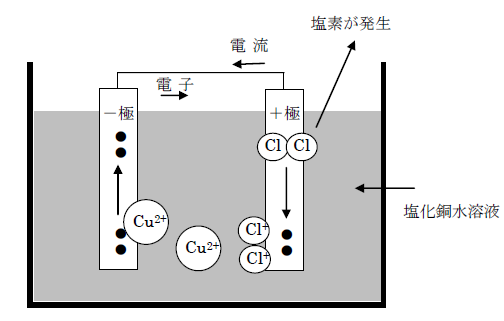
電気分解とは、電解質の水溶液に電流を流すと、陽極と陰極に物質が生じます。塩化銅水溶液(青色)に電圧をかえると、陽極に塩素が生じ、陰極に銅が付着します。電気分解が進むと、青色がうすくなります。
- 塩化銅の電離…銅イオンCu2+と塩化物Cl–が1:2の数の比で電離します。
- 陰極での変化…Cu2+が電子を2個受け取ってCuとなり、電極に付着する。
- 陽極での変化…Cl–が電子を放出してClとなり、2個結合してCl2となって発生します。
銅原子
銅原子は原子核中に陽子を29個もちます。このとき銅原子のもつ電子数は29個、塩化銅水溶液にふくまれる銅イオンのもつ電子数は27個となります。
したがって、陽子を29個もつ銅原子は、電子も29個もちます。
銅イオンは、銅原子が電子を2個失って、+の電気を帯びたものなので、電子を29-2=27個となります。


コメント