中1理科の「蒸留(水とエタノールの混合物の実験)」についてまとめています。蒸留(蒸留とは、液体を沸騰させて、出てくる期待を冷やして再び液体にして取り出すこと)の水とエタノールの混合物の実験です。沸点の違いを利用することがポイントです。蒸留の実験を詳しくみていきましょう。それでは、中1理科の「蒸留(水とエタノールの混合物の実験)」のまとめです。
【ポイント】蒸留の実験について
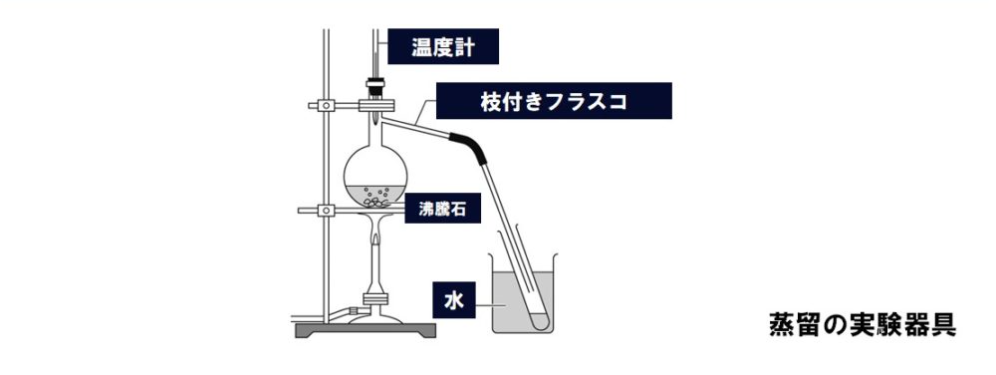
水50cm3とエタノール50cm3を混ぜたものを加熱。
蒸留の実験の注意点
- 急な突沸を防ぐため、沸騰石を入れておきます。
- 加熱は一定の強さで行い、時間と出てくる蒸気の温度との関係を記録します。
蒸留の実験の手順
- 沸騰が始まったら、出てきた液体を試験管Aに約5cm3分集める。
- さらに加熱を続け、フラスコ内の液体が1/3くらいになったら、出てきた液体を試験管Bに約5cm3分集める。
- 試験管A, Bに集めたそれぞれの液体について、次のことを行ってみる。
蒸留の実験の考察
- においをかいでみる。
- 塩化コバルト紙につける。
- 液体をひたしたろ紙をペトリ皿に置き、火をつける。
(注意点)エタノールは燃えやすい液体なので、この装置のように直接加熱しない方法をとります。
蒸留の実験の実験の結果
【1】におい
- 試験管Aの液体 (はじめに出てきたもの)…エタノールのにおい
- 試験管Bの液体 (あとから出てきたもの)…少しエタノールの においがする
【2】塩化コバルト紙につけたとき
- 試験管Aの液体 (はじめに出てきたもの)…赤色に変化
- 試験管Bの液体 (あとから出てきたもの)…赤色に変化
【3】火をつけたとき
- 試験管Aの液体 (はじめに出てきたもの)…火がつく
- 試験管Bの液体 (あとから出てきたもの)…火はつかない
蒸留の実験でわかったこと
水とエタノールの混合物を蒸留すると、はじめに沸点の低いエタノールが多く出て、あとから水が出てくる。(ただし、水とエタノールは沸点が近いため、それぞれ純粋な物質が得られるわけではありません)
蒸留以外に混合物を分ける方法
蒸発法と再結晶があります。
蒸発法
水がなくなるまで加熱し、蒸発させる。
[液体+固体]を分ける。〔例〕水+食塩 [食塩水]
再結晶
溶媒(水)にとけている物質を、温度を下げていくことで結晶として取り出す。
[液体+固体]を分ける。〔例〕ホウ酸など
【対策問題】中1理科「蒸留の実験のテスト対策問題」

コメント