中1理科「溶解度曲線のテスト対策問題」です。
【ポイント】中1理科「物質の溶解度と再結晶のポイントまとめ」
溶解度の問題
問1 次の図は、いろいろな物質の溶解度曲線を示したものである。次の問いに答えなさい。
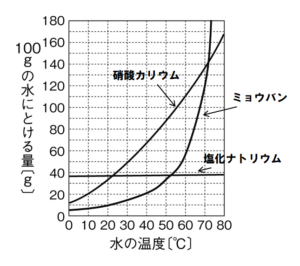
(1) 図の物質のうち、10°Cの水 100gにとけるだけとかしたとき、とけた質量がもっとも大きいものはどれか。
(2) 図の物質のうち、40°Cの水 100gにそれぞれの物質を50g加えたとき、すべてとけたものはどれか。
(3) 60°Cの水100gに図の物質をそれぞれ加えて飽和水溶液をつくり、10°Cまで冷やしたとき、結晶が最も多く出てくる物質はどれか。また、このときに出てきた結晶の質量は約何gか。次のア~エから選びなさい。
ア:50g イ:70g ウ:90g エ:110g
(4) (3)のように、固体の物質をいったん水にとかし、溶解度の差を利用して、再び結晶として固体をとり出すことを何というか。
問2 次の問いに答えなさい。
(1)水100gに溶ける物質の限界の質量を何というか。
(2)水溶液の温度を下げて、溶けていた物質を結晶として取り出せるのは、温度にとる溶解度の違いが大きい物質か、小さい物質か。
(3)水を冷やしても、食塩とミョウバンでは、ミョウバンの結晶は出てくるが、食塩の結晶はほとんど出てきません。その理由を【食塩の溶解度は】の書き出しで説明せよ。
溶解度の問題の解答
問1
(1) 塩化ナトリウム
溶解度曲線から10°Cの水100gには、塩化ナトリウムは約36g,硝酸カリウムは約22g,ミョウバンは約8gとけることがわかる。
(2) 硝酸カリウム
溶解度曲線から40°Cの水100gに50g以上とけるのは、硝酸カリウムだけであることがわかる。
(3) 物質…硝酸カリウム/記号…ウ
60°Cの水100gの飽和水溶液には、硝酸カリウムは約110g,ミョウバンは約57g,塩化ナトリウ ムは約37gとけている。これらの飽和水溶液を10°Cまで冷やすと,硝酸カリウムは110-22=88g,ミョウバンは57-8=49g,塩化ナトリウムは 37-36=1gが結晶として出てくる。
(4) 再結晶
問2
(1)溶解度
(2)大きい物質
(3)食塩の溶解度は温度が下がってもほとんど変化しないから

コメント