中1理科「物質の状態変化のポイントまとめ」です。
状態変化のポイント
物質の加熱
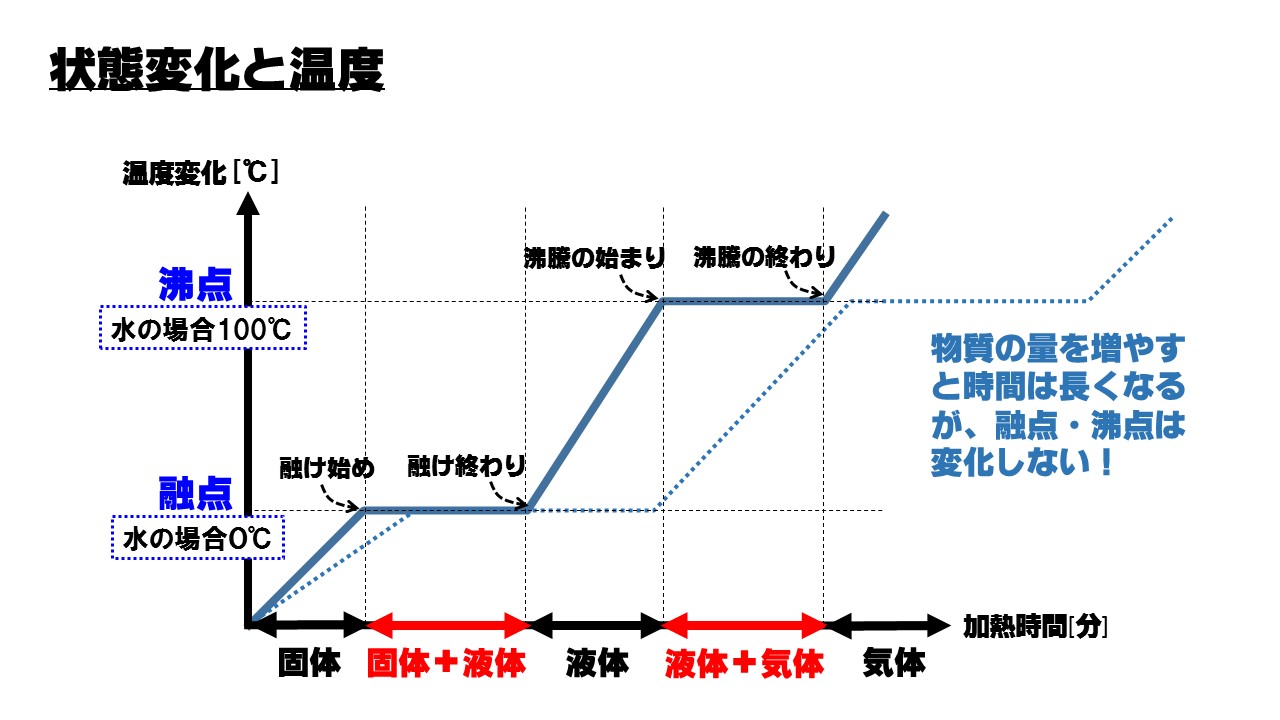
注意図にも書いてあるように、融点や沸点は、物質の量とは、無関係です。ただし、物質の質量が大きく(多く)なると、状態変化にかかる時間は長くなる(比例する)。(例)質量が2倍になると、時間も2倍かかる。
物質の状態は、固体、液体、気体の3つ。加熱や冷却で、物質の状態が変わることを状態変化という。ナフタレインのように、液体の状態を経ないで、固体⇔気体の変化する(昇華するという。)物質もある。
また、物質の状態が変化しても、質量自体は変わりません。しかしながら、液体の状態の水やエタノールが気体の状態になると、体積が大きく増えます。気体の状態から、液体の状態になると、体積は逆に大きく減ります。液体⇔個体の変化では、水とロウで変わるので、以下を参照してください。
融点
融点とは、固体の物質を加熱すると、じわじわと温度が上昇してきます。ある温度に達すると温度がそれ以上上昇しなくなります。このとき物質は融け始め、固体から液体に状態が変化していきます。このときの温度のこと。つまり、融点は、物質が溶け始める温度ということ。
純粋な物質の沸点は、物質によって決まった値を示し、沸騰中の温度が一定で変化しません。水の沸点は、100℃、エタノールの沸点は約78℃です。
水とエタノールの混合物の温度変化は、混合物なので、加熱するとエタノールの沸騰付近で沸騰をはじめ、温度の上昇がゆるやかになり、一定にはなりません。加熱を続けると、沸騰しながら上昇し、水の沸点で一定になります。
沸点
沸点とは、物質が完全に融け終わると、また温度が上昇しはじめます。ある温度に達すると今度は沸騰が始まり、温度が一定で上昇しなくなります。このときの温度。つまり、沸点は、物質が沸騰しはじめる温度ということ。
- 融点に達するまでは、固体だけの状態
- 融点のときは、固体と液体が混じっている状態
- 融点から沸点の間のときは、液体だけの状態
- 沸点のときは、液体と気体が混じっている状態
- 沸点より温度が高いときは、気体だけの状態
蒸留
蒸留とは、液体を沸騰させて、出てくる期待を冷やして再び液体にして取り出すことです。蒸留を使った混合物の分離は、沸点のちがいを利用し、蒸留することによって分離できます。はじめに沸点の低い物質が気体となって多く出てきます。
水とエタノールの混合物の蒸留では、はじめエタノールが沸騰し、次に水が沸騰します。エタノールの沸点付近で集まる液体にはエタノールが多く、水の沸点付近で集まる液体はほとんどが水となります。
沸点の違いを利用して、混合物を分ける。
液体 + 液体を分ける〔例〕水 + エタノール(赤ワインなど)
蒸発法
水がなくなるまで加熱し、蒸発させる。
[液体 + 固体]を分ける。〔例〕水 + 食塩 [食塩水]
再結晶
溶媒(水)にとけている物質を、温度を下げていくことで結晶として取り出す。
[液体 + 固体]を分ける。〔例〕ホウ酸など

コメント