中1理科「質量パーセント濃度の対策問題」です。こんにちは!今回は中学1年生の理科で学ぶ「質量パーセント濃度」について、テスト対策に役立つ問題とその解き方を解説していきます。
「質量パーセント濃度」は、溶液の濃さを表す計算で、日常生活にも関係する場面が多いテーマです。例えば、料理で使う塩水やジュースの濃さを考えるときにも応用できます。しかし、公式の使い方や計算ミスで悩む人も多いのではないでしょうか?
この記事では、公式の基本から応用まで丁寧に説明し、分かりやすい例題を通して苦手を克服できるようサポートします。テストで自信を持って得点できるよう、一緒に学んでいきましょう!
【問題】質量パーセント濃度のテスト対策問題
問1 図のように、ある温度の水230gにホウ酸20gを加えて、よくかき混ぜたところ、ホウ酸がすべてとけた。次の問いに答えなさい。
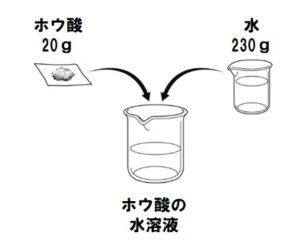
(1) 図のホウ酸のように、水にとけた物質を何というか答えなさい。
(2) 図のホウ酸の水溶液の質量パーセント濃度は何%か求めなさい。
(3) ホウ酸の水溶液のように、いくつかの物質が混じり合ったものを何というか答えなさい。
(4) 水溶液に共通する特徴を、次のア~エから1つ選びなさい。
ア 顕微鏡で観察すると, とけた物質が見える。
イ 水溶液はすべて無色透明である。
ウ 水溶液の濃さはどこも同じである。
エ やがて下の方が濃くなってくる。
問2
次の問いに答えなさい。
- 濃度は、溶質の質量÷( )の質量×100で求めることができる。( )には、溶液、溶質、溶媒のどれが入るか。
- 食塩20gを水80gに溶かしたときの濃度は何%か。
- 食塩20gが溶けた食塩水80gの濃度は何%か。
- 濃度40%の食塩水200gには何gの食塩が溶けているか。
【ポイント】質量パーセント濃度のポイント
質量パーセント濃度は水溶液にふくまれている溶質の質量の割合を表します。
<用語の確認>
- 溶質…溶けている物質のこと
- 溶媒…溶質を溶かす液体のこと
- (水)溶液…溶質と溶媒を合わせたもの
溶質についてですが、溶質は固体とはかぎらず、エタノール水溶液などの液体や塩酸などの気体の場合もあります。水溶液の性質として、色のついてものとついていないものがありますが、どちらも透き通っています。水溶液の性質は、溶けている物質(溶質)によって変わります。
物質は、たいけん小さな粒子からできています。物質が水に溶けると、集まっていた物質の粒子がバラバラに分かれ、水の粒子の間に入り込みます。このため、目には見えなくなります。ばらばらになった粒子は、散らばって動きまわっています。このため、時間がたっても下の方に集まってくることはありません。
濃度を求める計算式
- 濃度(%)=(溶質÷溶液)×100
- 濃度(%)={溶質÷(溶媒+溶質)}×100
36%の塩酸とは、塩酸100g中には、塩化水素が36g溶けているということです。
濃度の計算方法
次の手順で行います。
- 溶媒と溶質を合わせた溶液の質量を求める((水)溶液全体の重さを求めます。)
- 溶質÷(水)溶液で溶質占める割合を計算する(分数式で表すと分子が溶質、分母が(水)溶液の質量です。)
- 最後に100倍にして百分率(%)を求めます。
【解答・解説】質量パーセント濃度のテスト対策問題の解答
問1
(1) 溶質
(2) 8%
(3) 混合物
(4) ウ
イ…水溶液は透明であるがコーヒーシュガーや硫 酸銅の水溶液のように、色がついているものもある。
エ…水溶液の濃さは、時間がたっても、どの部分も同じである。
問2
- 溶液
- 20%
- 25%
- 80g



コメント