中2理科「いろいろな化学変化のポイントまとめ」です。
いろいろな化学変化
酸化、燃焼、熱分解、還元、電気分解とさまざまな化学変化について、ポイントをまとめています。最後に、対策問題もついているので、ご利用ください。
【ポイント】酸化
酸化とは、酸素によって起こる物質の反応のことです。物質が酸素と反応して酸化物を形成することが一般的です。金属が酸素と反応して酸化物を形成することがあります。例えば、鉄は酸素と反応して酸化鉄を生成します。この反応は錆びとして知られています。
【ポイント】鉄と硫黄の化合(硫化)
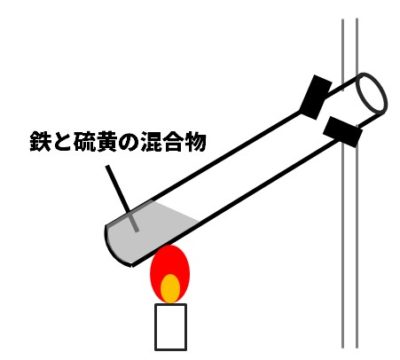
化合とは、2種類以上の物質が結びついて1種類の物質ができる化学変化。たとえば、鉄と硫黄を化合させると、硫化鉄(黒色)ができます。鉄と硫黄を化合の実験では、はじめに加熱するのは、反応のきっかけをつくるだけです。上部で反応が始まったら勝手に発熱して反応が進んでいきます。。混合物に水を少量加えて練ってだんごにして放置しておくだけでも発熱して硫化鉄ができます。
鉄と硫黄の混合物
- 磁石につく→鉄の性質がある
- 鉄とうすい塩酸が反応して水素を発生
硫化鉄(化合物)
- 磁石につかない→鉄の性質はない
- 硫化鉄とうすい塩酸が反応して硫化水素を発生
硫化水素は有毒(卵が腐ったような臭いがする)なので、たくさん吸い込まないように気をつけながら手であおぐようにしてにおいをかぐことが必要です。
鉄と硫黄の混合物と硫化鉄(化合物)
| 加熱前の物質 | 加熱後の物質 | |
| 物質名 | 鉄と硫黄 | 硫化鉄 |
| 磁石を近づける | 引き合う | 引き合わない |
| 水に入れる | 硫黄が浮く | 全て沈む |
| うすい塩酸を入れる | 水素が発生する | 硫化水素が発生 |
【ポイント】燃焼
燃焼は、物質が熱や光を出しながら酸素とはげしく化合することです。
【ポイント】マグネシウムリボンの燃焼
マグネシウムリボンを空気中で燃焼させると、白色の酸化マグネシウムができます。加熱していないマグネシウムリボンをうすい塩酸を入れると水素が発生しますが、酸化マグネシウムをうすい塩酸にいれても気体は発生しません。
●化学反応式
- マグネシウム+酸素→酸化マグネシウム
2Mg+O2→2MgO
【ポイント】スチールウールの燃焼
スチールウール(鉄)を空気中で燃焼させると、黒色の酸化鉄ができます。燃焼後にできた酸化鉄の質量は、化合した酸素の分だけ燃焼前のスチールウールの質量よりも大きくなります。加熱していないスチールウール(鉄)をうすい塩酸に入れると水素が発生しますが、酸化鉄をうすい塩酸にいれても気体は発生しません。
実験前後の変化
| 加熱前 | 加熱後 | |
| 物質 | 鉄 | 酸化鉄 |
| 色 | 銀白色 | 黒色 |
| 電流 | 流れる | 流れない |
| もむと | 弾力がある | ぼろぼろくずれる |
| うすい塩酸 | 水素発生 | 変化しない |
【ポイント】熱分解
熱分解は、加熱によって2つ以上の物質に分かれる分解反応のことをいう。物質が熱エネルギーの作用で分解される現象です。物質が高温にさらされると、その分子や化合物が熱エネルギーの影響で分解して、異なる物質や元素に変化します。
【ポイント】炭酸水素ナトリウムの熱分解
炭酸水素ナトリウムを熱分解すると、炭酸ナトリウム、水(H2O)、二酸化炭素(CO2)に分解されます。ポイントは、炭酸水素ナトリウムと炭酸ナトリウムの比較です。
| 比較 | 炭酸水素ナトリウム | 炭酸ナトリウム |
|---|---|---|
| 実験 | 前 | 後 |
| 水への溶け方 | 少し溶ける | よく溶ける |
| 水溶液にフェノールフタレイン液を加える | うすい赤色 | 濃い赤色 |
炭酸水素ナトリウムの加熱実験(熱分解)の注意点
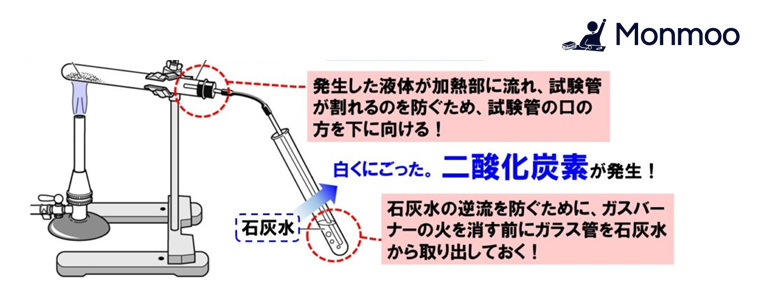
- 発生した液体(水)が加熱部に流れると試験管が割れる危険性があるので、試験管の口は下げて加熱します。
- 石灰水が試験管に逆流しないように、ガラス管を石灰水から抜いて加熱をやめます。
実験前後の違い
- 加熱後に残る白い物質は、水に溶けやすく、フェノールフタレイン溶液を入れると濃い赤色になります。加熱後に残る物質は炭酸ナトリウムです。
- 加熱後に、試験管の口付近につく液体に青色の塩化コバルト紙をつけると、青色から赤色に変化します。加熱後に生じた液体は水です。
- 発生した気体を石灰水に通すと、石灰水が白くにごります。加熱後に発生した気体は二酸化炭素になります。
【ポイント】酸化銀の熱分解
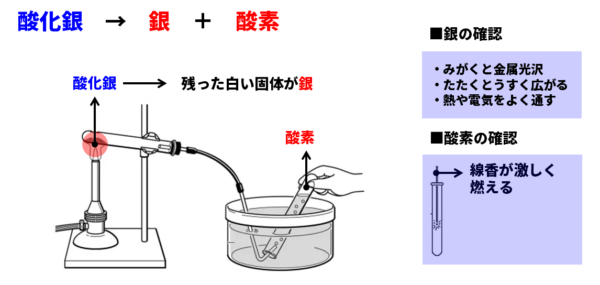
酸化銀は黒色の粉末で、加熱すると次のように分化します。
- 酸化銀→酸素+銀
分解によって生成する2種類の物質のうち、酸素は火のついた線香をこの気体の中に入れると炎をあげて燃えることから確認できます。銀は、白色の粉末として残りますが、平らな台の上に置いて試験管の底でこすると金属光沢が出て、銀であることが確認できます。
■ 金属の性質
- 展性…たたくと薄く広がる
- 延性…引っ張ると細く伸びる
- 金属光沢…磨くと光る(金属特有の輝き)
- 電気伝導性…電気をよく通す
- 熱伝導性…熱が伝わりやすい
酸化銀の熱分解の化学反応式
まずは、登場する物質の化学式を覚えましょう。
- 酸化銀…Ag2O
- 銀…Ag
- 酸素…O2
次に化学反応式をつくります。
酸化銀→銀+酸素
Ag2O→Ag+O2
両辺の原子の数が等しくなるように係数をつけると、
入試でもよく登場する化学反応式になります。
加熱装置を使うときの注意点
➊固体を加熱するとき…固体は試験管の底のほうに入れ、試験管の口を少し下げておきます。試験管の口の付近について水が底のほうに流れると、試験管が割れることがあります。
➋液体を加熱するとき…必ず沸騰石を入れて加熱します。沸騰石を入れないと、沸騰がおこり、液体が飛び出て危険です。
【ポイント】酸化銅の還元
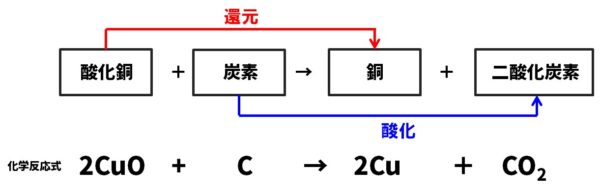
- 銅を空気中で加熱すると、空気中の酸素が化合して黒色の酸化銅になります。この酸化銅を、炭の粉(炭素)を混ぜて加熱すると、酸化銅から酸素が外れて銅に還元され、炭素は逆に酸素が化合して二酸化炭素になります。
- 黒色の酸化銅ですが、炭素によって完全に還元が完了すると、赤褐色の銅になります。
- 酸化銅は、炭素Cだけでなく水素H2によっても還元できます。これは、酸素Oが銅Cuよりも水素Hと結合しやすいからです。水素は酸化されて水になります。
一定の質量の金属と化合する酸素の質量は決まっています。金属を加熱すると、化合した酸素分だけ質量が増えていくが、やがて酸素がそれ以上化合しなくなり、一定の質量になります。加熱の回数を増やしていくと、質量が増えなくなり一定になるということです。すべての酸素と化合したからです。
還元の発展内容
還元は、酸化と逆の反応を還元といいます。還元は、酸化された金属がもとの金属にもどる(還元する)ということからきたものです。還元は、 酸化物から酸素の一部または全部を取り除くこと、あるいは、ある物質に水素を化合させる反応ということになります。
たとえば、つぎの反応で酸化銅に着目すると、酸素が取り除かれているので、還元です。
- CuO + H2 → Cu + H2O (酸化銅+水素→銅+水)
さらに広い意味では、原子または原子団が電子を受け取る反応を還元ということがあります。たとえば、塩化ナトリウムはナトリウムイオンNa+と塩化物イオンCl–とが結合したものであると考えられる。
電気分解の例では、Na+電子1個→金属ナトリウムという式で表される反応がおこり、ナトリウムイオン は陰極で電子1個を受け取って金属ナトリウムに変化します。
- 2Na++C– → 2Na(陰極) + Cl2(陽極) (塩化ナトリウム→金属ナトリウム+塩素)
これも還元の例である。
酸化と還元
酸化と還元は、ふつう同時におこります。その場合、全体の化学反応を酸化・還元反応といいます。
●酸化銅の還元
酸化銅を水素で還元するときの反応は、つぎのように表されます。
- CuO + H2 → Cu + H2O (酸化銅+水素→銅+水)
この反応で、酸化銅は還元されて銅になりますが、水素は酸化されて水になっています。酸化銅に着目すれば還元であり、水素に着目すれば酸化です。反応物のどれに着目するかによって、酸化と還元ともみることができます。
酸素やオゾンのほか、 酸素を放ちやすい化合物です。 たとえば、過酸化水素、酸化水銀、熱した酸化銅、二酸化マンガン、二酸化鉛、亜硝酸・硝酸・過マンガン酸カリウム・クロム酸・塩素酸・次亜塩素酸などとその塩、熱濃硫酸、塩素、臭素などのハロゲンが酸化剤として用いられます。酸化・還元反応で還元される反応物を、酸化剤ということもあります。
不安定な水素化合物、炭素、一酸化炭素、亜硫酸とその塩、ナトリウム・ マグネシウム・カルシウム・ アルミニウム・亜鉛などの金属、鉄塩、塩化スズなどが還元剤となります。また、酸化・還元反応において、酸化される側の反応物を還元剤ということもありいます。
【ポイント】水の電気分解
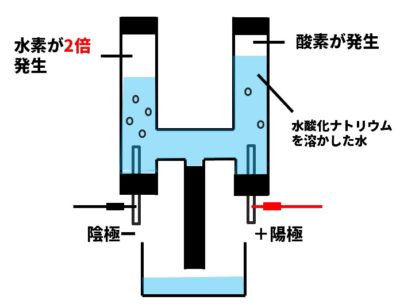
水は加熱するだけでは、水蒸気になり分解しないので、電流を流して分解します。電流によって分解することを、電気分解といいます。しかしながら、水はきわめてわずかの電流しか通さないので、水酸化ナトリウム水溶液やうすい硫酸などを加えて電流がよく流れるようにします。
- <水の電気分解> 水→水素+酸素 (体積比は、水素:酸素=2:1)
電解液
電流が流れる水溶液のことで、水の電気分解では、うすい水酸化ナトリウム水溶液やうすい硫酸などを使います。このとき。水酸化ナトリウムや硫酸は電流を流すはたらきをするだけで、電流によって分解されることはありません。
発生する気体の確認法
陰極にたまった気体に火を近づけると、ポッと燃えることから陰極には水素が、陽極にたまった気体に線香を入れると、炎をあげて燃えることから陽極には酸素が発生していることが確認できます。
たまった気体のガラス管中での高さを見ると、水素と酸素の体積の比は、水素:酸素=2:1になっていることがわかります。
加熱装置を使うときの注意点
●個体を加熱するとき
固体は試験管の底のほうに入れ、試験管の口を少し下げておきます。試験管の口の付近についた水が底のほうに流れると、試験管が割れることがあります。
●液体を加熱するとき
必ず沸騰石を入れて加熱することです。沸騰石を入れないと、突沸がおこり、液体が飛び出て危険です。

コメント